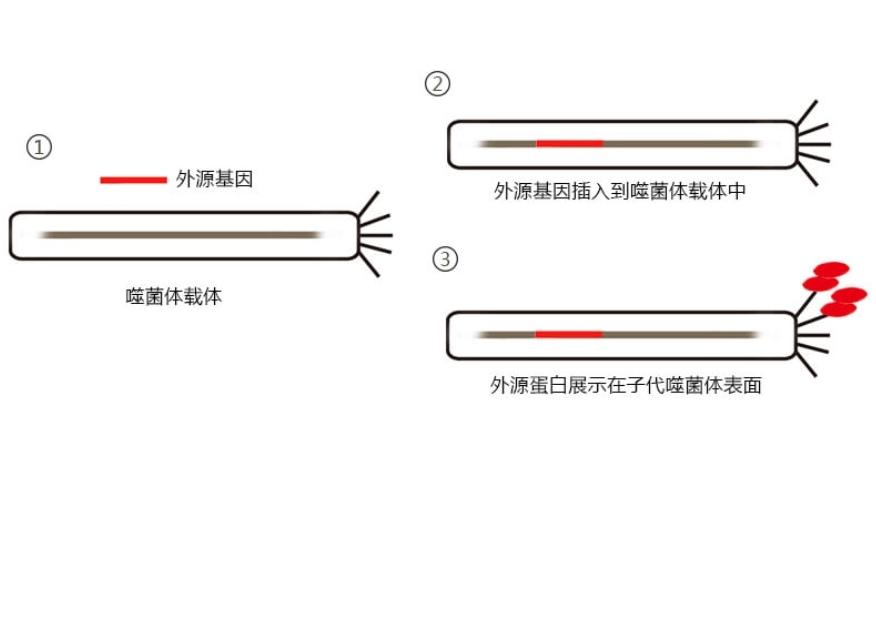
原理
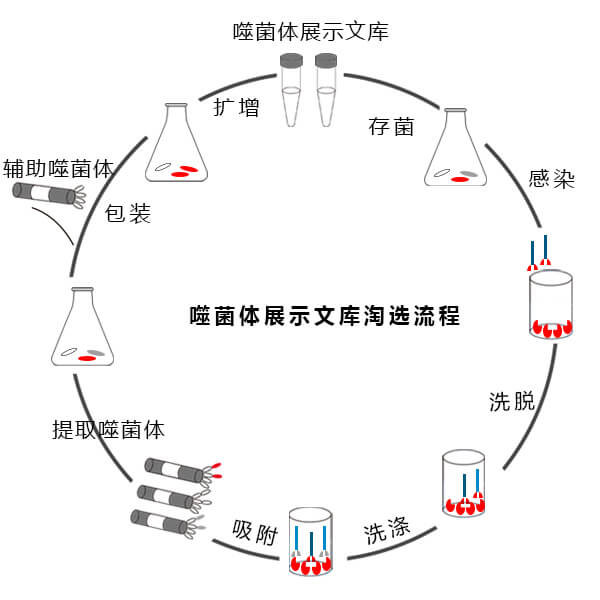
生物淘洗法筛选噬菌体展示文库
噬菌体展示技术(phage display technology)的本质是一种筛选技术。将不同的外源基因分别插入噬菌体载体中,随着噬菌体的传代,外源蛋白会展现在噬菌体表面,形成噬菌体文库。随后用特定蛋白对噬菌体文库进行筛选,便可快速的得到与该蛋白具有高度亲和力的抗体。筛选出的抗体可以进一步用于生物学功能研究。[1]
噬菌体展示技术是将多肽或蛋白质的编码基因或目的基因片段克隆入噬菌体外壳蛋白结构基因的适当位置,在阅读框正确且不影响其他外壳蛋白正常功能的情况下,使外源多肽或蛋白与外壳蛋白融合表达,融合蛋白随子代噬菌体的重新组装而展示在噬菌体表面。
被展示的多肽或蛋白可以保持相对独立的空间结构和生物活性,以利于靶分子的识别和结合。肽库与固相上的靶蛋白分子经过一定时间孵育后,洗去未结合的游离噬菌体,然后以竞争受体或酸洗脱下与靶分子结合吸附的噬菌体,洗脱的噬菌体感染宿主细胞后经繁殖扩增,进行下一轮洗脱,经过3轮~5轮的“吸附-洗脱-扩增”后,与靶分子特异结合的噬菌体得到高度富集。所得的噬菌体制剂可用来做进一步富集有期望结合特性的目标噬菌体。
系统
单链丝状噬菌体展示系统
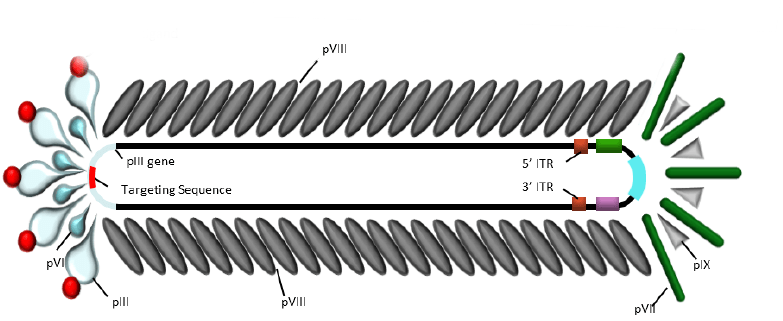
丝状噬菌体结构
(1)PⅢ展示系统。丝状噬菌体是单链DNA病毒,PⅢ是病毒的次要外壳蛋白,位于病毒颗粒的尾端,是噬菌体感染大肠埃希菌所必须的。每个病毒颗粒都有3个~5个拷贝PⅢ蛋白,其在结构上可分为N1、N2和CT 3个功能区域[4-5],这3个功能区域由两段富含甘氨酸的连接肽G1和G2连接。其中,N1和N2与噬菌体吸附大肠埃希菌菌毛及穿透细胞膜有关,而CT构成噬菌体外壳蛋白结构的一部分,并将整个PⅢ蛋白的C端结构域锚定于噬菌体的一端。
PⅢ有2个位点可供外源序列插入,当外源的多肽或蛋白质融合于PⅢ蛋白的信号肽(SgⅢ)和N1之间时,该系统保留了完整的PⅢ蛋白,噬菌体仍有感染性;但若外源多肽或蛋白直接与PⅢ蛋白的CT结构域相连,则噬菌体丧失感染性,这时重组噬菌体的感染性由辅助噬菌体表达的完整PⅢ蛋白来提供。PⅢ蛋白很容易被蛋白水解酶水解,所以有辅助噬菌体超感染时,可以使每个噬菌体平均展示不到一个融合蛋白,即所谓“单价”噬菌体。
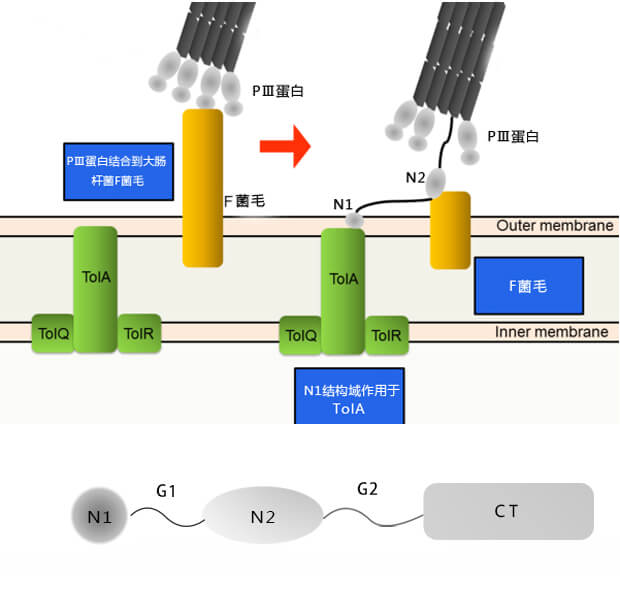
PⅢ蛋白结构域及其功能
(2)PⅧ及其他展示系统。PⅧ是丝状噬菌体的主要外壳蛋白,位于噬菌体外侧,C端与DNA结合,N端伸出噬菌体外,每个病毒颗粒有2 700个左右PⅧ拷贝[8-9]。PⅧ的N端附近可融合五肽,但不能融合更长的肽链,因为较大的多肽或蛋白会造成空间障碍,影响噬菌体装配[2,10-11],使其失去感染力。但有辅助噬菌体参与时,可提供野生型PⅧ蛋白,降低价数,此时可融合多肽甚至抗体片段。
此外,尚有丝状噬菌体PⅥ展示系统的研究报道。PⅥ蛋白的C端暴露于噬菌体表面,可以作为外源蛋白的融合位点,可以用于研究外源蛋白C端结构区域功能。从所掌握的文献来看,该系统主要用于cDNA表面展示文库的构建,并取得了不错的筛选效果。
λ噬菌体展示系统
(1)PV展示系统。λ噬菌体的PV蛋白构成了它的尾部管状部分,该管状结构由32个盘状结构组成,每个盘又由6个PV亚基组成。PV有两个折叠区域,C端的折叠结构域(非功能区)可供外源序列插入或替换。用PV系统已成功展示了有活性的大分子蛋白β-半乳糖苷酶(5ku)和植物外源凝血素BPA(120ku)等。λ噬菌体的装配在细胞内进行,故可以展示难以分泌的肽或蛋白质。该系统展示的外源蛋白质的拷贝数为平均1个分子/噬菌体,这表明外源蛋白质或多肽可能干扰了λ噬菌体的尾部装配。
(2)D蛋白展示系统。D蛋白的分子质量为11ku,参与野生型λ噬菌体头部的装配。低温电镜分析表明,D蛋白以三聚体的形式突出在壳粒表面。当突变型噬菌体基因组小于野生型基因组的82%时,可以在缺少D蛋白的情况下完成组装,故D蛋白可作为外源序列融合的载体,而且展示的外源多肽在空间上是可以接近的。
病毒颗粒的组装可以在体内也可以在体外,体外组装即是将D融合蛋白结合到λD-噬菌体表面,而体内组装是将含D融合基因的质粒转化入λD-溶源的大肠埃希菌菌种中,从而补偿溶源菌所缺的D蛋白,通过热诱导而组装。该系统有一个很好的特点,噬菌体上融合蛋白和D蛋白的比例可以由宿主的抑制tRNA活性加以控制,这对于展示那些可以对噬菌体装配造成损害的蛋白质时特别有用。
T4噬菌体展示系统
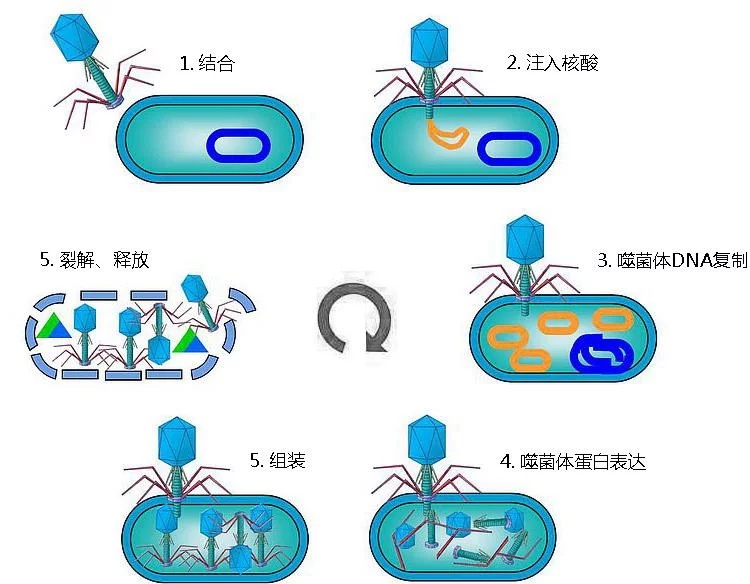
噬菌体展示技术
T4噬菌体展示系统是20世纪90年代中期建立起来的一种新的展示系统。它的显着特点是能够将两种性质完全不同的外源多肽或蛋白质,分别与T4衣壳表面上的外壳蛋白SOC(9ku)和HOC(40ku)融合而直接展示于T4噬菌体的表面,因此它表达的蛋白不需要复杂的蛋白纯化,避免了因纯化而引起的蛋白质变性和丢失。T4噬菌体是在宿主细胞内装配,不需通过分泌途径,因而可展示各种大小的多肽或蛋白质,很少受到限制。
吴健敏等成功地将大小约215aa SOC/m E2融合蛋白展示于T4噬菌体衣壳表面。令人值得关注的是,SOC与HOC蛋白的存在与否,并不影响T4的生存和繁殖。SOC和HOC在噬菌体组装时可优于DNA的包装而装配于衣壳的表面,事实上,在DNA包装被抑制时,T4是双股DNA噬菌体中唯一能够在体内产生空衣壳的噬菌体(SOC和HOC也同时组装)。因此,在用重组T4做疫苗时,它能在空衣壳表面展示目的抗原,这种缺乏DNA的空衣壳苗,在生物安全性方面具有十分光明的前景。
缺点分析
(1)在噬菌体展示过程中必须经过细菌转化、噬菌体包装,有的展示系统还要经过跨膜分泌过程,这就大大限制了所建库的容量和分子多样性。常用的噬菌体展示文库中含有不同序列分子的数量一般限制在109。
(2)不是所有的序列都能在噬菌体中获得很好的表达,因为有些蛋白质功能的实现需要折叠、转运、膜插入和络合,导致在体内筛选时需外加选择压力。例如,在噬菌体展示文库试验中,由于部分未折叠的蛋白在细菌中很容易被降解,因此,必须小心控制条件,以保证在噬菌体表面展示的文库没有降解。另外,鼠源抗体在噬菌体中表达差,也是体内选择压力的一个例子。真核细胞蛋白在细菌中表达差是因为它们的蛋白质合成与折叠机制不同的缘故。
(3)噬菌体展示文库一旦建成,很难再进行有效的体外突变和重组,进而限制了文库中分子遗传的多样性。
(4)由于噬菌体展示系统依赖于细胞内基因的表达,所以,一些对细胞有毒性的分子如生物毒素分子,很难得到有效表达和展示。
噬菌体展示技术(moture_xu编辑)
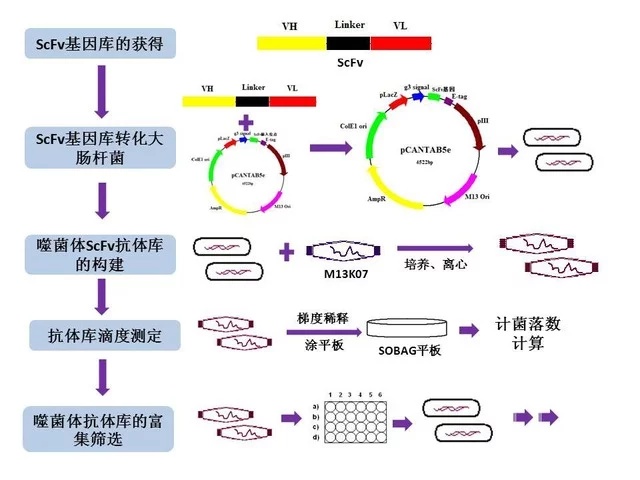
噬菌体展示文库构建
确定抗原表位,包括表位的序列和构象,是免疫学家感兴趣的一个问题。表位的确定不仅可以了解有关免疫反应的众多信息,为进一步人工控制免疫反应奠定基础,而且对药物合成、疫苗设计等也具有指导意义。确定表位常用的方法有:还原法、蛋白印迹法、肽扫描、突变分析等,后两种方法还同时解决了蛋白分子一级序列问题。但这些方法大多困难而繁琐。
近几年来,噬菌体展示技术成为探测蛋白空间结构、探索受体与配体之间相互作用结合位点、寻找高亲和力和生物活性的配体分子的有利工具,在蛋白分子相互识别的研究、新型疫苗的研制以及肿瘤治疗等研究领域产生了深远的影响。肽库(peptide library)的应用为确定表位序列以至其构象提供了另一有力工具。
噬菌体展示肽库是以噬菌体外壳蛋白PⅢ或PⅧ基因为载体,插入一段编码外源短肽的基因片段,噬菌体的浸染能力不受到影响,而外源短肽亦可在噬菌体表面PⅢ或PⅧ蛋白N末端形成一定的空间构象。1990年Scott将随机短肽与丝状噬菌体的表面蛋白PⅢ融合,并展示在噬菌体表面,首次建立了噬菌体随机肽库。
从噬菌体展示随机肽库中筛选抗原表位的基本原理是生物淘选(biopanning)。以单克隆抗体筛选蛋白质抗原表位为例,其基本技术流程如下:将单抗包被聚乙烯平皿后,再加入噬菌体展示肽库,使其充分与单抗反应后,洗去未结合的游离噬菌体,再用洗脱液将结合状态的噬菌体洗脱下来。将其浸染宿主大肠杆菌扩增后回收,再进行下一轮筛选。通常经过3、4轮的筛选,并且每次增加筛选强度,这样就可获得与单抗结合较紧密的噬菌体克隆。通过序列测定和分析,就能推知该噬菌体克隆所携带的外源短肽序列,从而确定该单抗所针对的抗原表位。
借助于噬菌体展示肽库技术,已经成功分析了多种蛋白质抗原的表位,如HIV(Keller et al,1993; 杜勇等,2000)、HBV、HCV(杜勇等,1999;Francesca et al,2001;潘卫等,2001)、日本血吸虫(欧阳理等,2002)等,说明完全可以利用随机肽库鉴定抗原的线性和构象表位,大大简化了重组免疫原的克隆、鉴定和表达等过程,为表位鉴定研究增添了新的手段。
丝状噬菌体具有免疫原性,无须佐剂即可产生抗体,这意味着噬菌体展示系统可以作为候选疫苗抗原表位的递呈工具。利用展示肉毒梭菌中和表位的噬菌体不加佐剂直接免疫小鼠,血清ELISA检测显示,免疫小鼠是对照小鼠的OD值的2~10倍。表明噬菌体展示的表位具有明显的抗原性。
噬菌体展示技术的优点
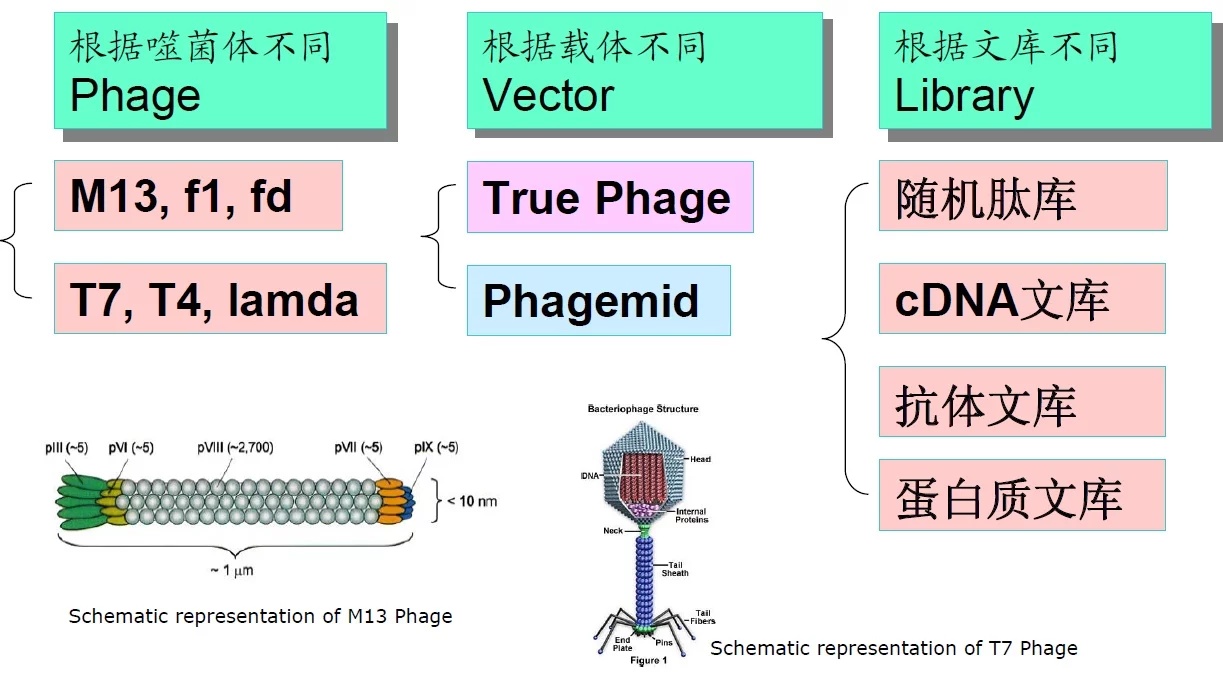
噬菌体展示技术
噬菌体展示技术作为一种新兴的研究方法和工具,在研究蛋白质结构上已被广泛应用。它具有很多显着的优点,如:
A.将靶标分子(抗体)固定在固相载体上,加入噬菌体展示肽库(噬菌体的数量可达1011 PFU),利用抗原-抗体的特异性亲和力将与抗体结合的噬菌体吸附在固相载体上,不能结合的噬菌体仍在溶液中,可以通过洗涤去除,再将特异结合的噬菌体洗脱下来,如此反复数轮扩增、淘选,即可将有用的基因从多达百万以上的噬菌体克隆中分离出来。
B.利用噬菌体展示技术得到模拟表位的报道较多(Giuseppe,2001;Seshi et al,2002;Ouyang et al,2003)。李全喜等(1997)利用单抗9E10筛选噬菌体随机肽库,结果获得了两个阳性克隆,其中一个与抗原天然序列同源,而另一个则完全不同(即为模拟表位)。模拟表位同样可诱发与天然表位相似的特异性免疫反应,例如利用乙肝病毒的模拟表位免疫小鼠可诱导产生高滴度的乙肝病毒抗体。
C.易于纯化重组噬菌体的纯化步骤简单、不要求昂贵的试剂与设备,在一般的实验室条件下就可以完成。用于鉴定表位和受体所用的噬菌体载体为13单链噬菌体。由于M13噬菌体是温和型噬菌体,不裂解宿主菌,成熟的噬菌体可分泌到培养基中,通过离心收集培养上清,再向其中加入沉淀剂即可将上清中大量噬菌体粒子沉淀下来,从而富集得到含外源基因产物的重组噬菌体。
尽管如此,在噬菌体展示技术中仍然存在一些不足。首先,所建的肽库容量只能达到109,要想构建大片段的肽库很困难。其次,需要解决肽库的多样性问题。第三,少数多肽由于疏水性过强,或由于影响外膜蛋白的折叠而不能展示在噬菌体表面。作为一种新技术,类似的具体问题还很多。但这些暂时的缺点并不能掩盖其巨大应用潜力。