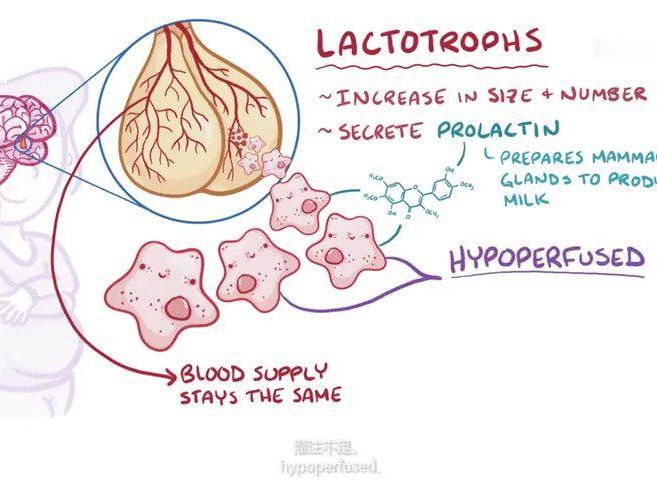
病症简介
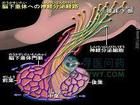
希恩综合征
产后垂体坏死引起者,称为希恩综合征(Sheehan’s Syndrome),泛称之为席汉氏综合征,常见的是在产后大出血或产褥感染伴休克或昏厥,随之出现垂体功能减退等一系列症候群。其临床表现为极度体力衰竭、产后无乳、贫血、渐进出现性征退化、闭经、毛发及牙齿脱落,性欲减退、畏寒、皮肤干燥等,严重者每有晕厥,甚至无明显诱因突然死亡。中医无相应病名,根据临床表现,似可归属于“产后虚劳”、“闭经”、“产后血晕”、“劳瘠”等范畴。
病因病理
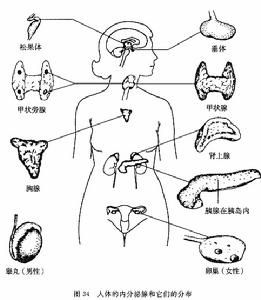
希恩综合征
中医对本病的认识,从其病史及临床表现可归于“产后虚劳”、“产后血晕”、“闭经”、“血枯经闭”、“劳瘠”等范畴。巢元方《诸病源候论》中的“产后虚赢侯”中曰“夫产损动脏腑,劳伤气血……故虚赢也,将养失所,多沉滞劳瘠,甚伤损者皆著床,此劳瘠也。”这与本病的病理机制和临床特征是十分接近的。本病的病因比较明了,病机较为复杂,按“辨证求因”原则分为虚、实两端,但绝大多数属虚。一般认为,主要病因为产后大出血,气随血脱,血少而不生精,致气耗津伤,血脱脉空,脏腑失却濡润,冲任虚衰,血海不充,胞宫失养,以致出现月事不下,毛发脱落,性欲减退,腰酸乏力等一系列虚劳表现,以此征象亦可确知在前有精血耗损之由。肾藏精,多产、堕胎、房劳或久病及肾,肾失所藏而虚损。肾阴虚和肾阳虚的本质都是肾之精气不足,而肾阴肾阳之间又相互制约、相互依存,维持着相对的动态平衡,一旦一方有所偏盛或偏衰,则会出现彼此损及的病理状态,故希恩综合征初见肾之精血不足,久则一派虚寒之肾阳虚见证。肾脾为先后天之本,肾为脾先天之源,脾为肾后天之充,它们相互依赖、相互滋生,肾阳不足则脾失温煦,故脾阳亦衰,而临床亦不独有肾阳虚,脾肾阳虚为最常见证型。肝藏血,受肾水涵养,血虚与肾阴不足,致肝失水涵血养,肝血虚少,冲任失于充养,源断其流,女子以肝为先天,肝血虚极则有生殖器萎缩,与性腺有关的组织退化等症状。[2]
临床表现
希恩综合征
病至后期出现一系列气血双亏、肾、脾、肝等脏均不足的临床表现。
1.脾肾阳虚,冲任不盛。肾藏精,精化血,为先天之本;脾统血,主运化,为后天之本。脾肾阳气互相资助,分娩大出血,脾虚血少,运化无权,化源不足,精亏血虚,冲任失养,而致虚劳、血枯经闭。
2.气血虚弱,血海无余。产后失血伤津,损及脏腑,冲任不盛,血海空虚,发为虚劳、经闭
3.肝肾虚损,津亏血少。肝藏血,肾藏精,肝肾同源,为冲任之本。产后大出血,精亏血虚,损伤冲任,冲脉不盛,任脉不通,遂成虚劳、经闭。
4.肾阳不足,命门火衰。分娩大出血,气随血脱,阳气衰微,命火不足,温煦无能,肾精亏耗,冲任失养,而发虚劳、血枯经闭。
综上所述其病机主要为气血虚损,脾肾阳虚,肝肾亏损,尤以肾虚为发病关键。
相关检查
(1)血常规、血电解质、血糖测定:垂体功能减退性昏迷可由于昏迷的逐渐出现而被误诊为脑血栓形成,由于颈部强直而误诊为脑膜炎,由于抽搐而被误诊为癫痫,由于脉搏缓慢而被误诊为心源性脑缺血综合征(阿-斯综合征),由于饥饿性酮尿而误诊为糖尿病昏迷,由于曾服用麻醉药而误诊为麻醉药中毒等。在临床上凡遇到原因不甚明确有昏迷患者,皆应提高警惕,考虑到垂体功能减退的可能性,而作详细的病史询问和全面检查。
(2)腺垂体激素及靶腺测定。
(3)必要时可进行腺垂体储备功能测试,如刺激生长激素(GH)、泌乳素(PRL)、胰岛素低血糖试验(有一定危险性,需仔细监测血糖)、黄体生成素释放激素(LHRH)兴奋试验、TRH兴奋试验。
(4)疑有占位病变者,可作眼底检查、视野检查、头颅正、侧位片、CT、磁共振检查。
并发症
希恩综合征
1.合并糖尿病
腺垂体功能减退症的病因,多为产后出血所致的垂体坏死,或为垂体迁徙性脓肿坏死、结节病累及垂体以及癌肿浸润垂体。不少病例的病因与全身性动脉硬化累及垂体、造成血栓形成有关。糖尿病的血管损害可能为发病的基础。临床表现按腺垂体功能减退症出现的缓急,可分为两型:
(1)慢性型:表现为糖尿病病人在治疗过程中变得对胰岛素特别敏感,易于出现低血糖,对胰岛素的需要量减少,并逐渐出现腺垂体功能减退症的各种表现。
(2)急性型:腺垂体功能减退症的起病急骤,由于垂体内出血或垂体脓肿和急性坏死等引起,病人除垂体局部病变所致的症状外,常表现为糖尿病骤然消失,发生低血糖昏迷。
糖尿病病人并发腺垂体功能减退症后,视网膜血管病变可好转,大约与生长激素的消除有关。生长激素可加重糖尿病的血管病变,因而可以用垂体切除术治疗糖尿病时的视网膜病变。
2.合并尿崩症
下丘脑或垂体部位的手术、肿瘤、炎症等,可同时引起尿崩症和腺垂体功能减退。引起产后腺垂体坏死的血管病变,有时也可损及视上核神经垂体束而并发尿崩症。腺垂体功能减退对尿崩症的病情有显著影响,合并此病后,多尿减轻,尿渗透压也较高;病人的肾小球滤过率降低,肾脏浓缩及稀释功能都受到限制,排泄水负荷的能力减弱;尿量取决于溶质的排泄量。发生此种现象的主要原因是糖皮质激素缺乏。糖皮质激素似与抗利尿激素有拮抗作用,但作用方式还未明确。有人认为糖皮质激素可抑制抗利尿激素的分泌,也有人认为糖皮质激素可能作用于肾脏,阻止集合管内水分的返回弥散。因此,当糖皮质激素缺乏时,抗利尿激素缺乏的现象也减轻。此外,糖皮质激素及甲状腺素减少时,溶质的排泄减少,也是使多尿减轻的一个原因。临床上需注意,有此两种病况合并存在时,补充糖皮质激素后,尿崩症的症状加重,对于加压素的需要量增多。对于原来只有尿崩症的病人,如病情减轻,要考虑发生腺垂体功能减退症的可能性。
3.合并妊娠
轻型腺垂体功能减退症的病人,尤其是经过甲状腺、肾上腺皮质和性腺的激素补充治疗后,偶尔可以妊娠。这可能是在激素补充治疗后,使机体的代谢状况改善,残余的垂体组织恢复了部分功能之故。妊娠期间,由于胎盘可产生多种激素,垂体组织也可增生,故腺垂体功能减退症的表现可减轻。在分娩时,需密切注意避免危象的发生,必要时应补充肾上腺皮质激素。分娩之后,腺垂体功能减退症可好转,但也可能恢复到原来的状况甚至加重。
4.可并发感染、垂体危象及昏迷。
垂体危象、昏迷的治疗:低血糖者应用50%葡萄糖溶液,静注,继以10%葡萄糖溶液500ml加氢化可的松100~200mg静滴。有感染、循环衰竭、低血压、休克时补充需要量的葡萄糖盐水加氢化可的松、抗生素、升压药静滴,必要时输血。低体温者应保温、应用三碘甲腺原氨酸,每次25ml,静注,每6小时1次,同时用氢化可的松50~100mg静滴。水中毒者应用氢化可的松100~150mg静滴。
治疗方法
一般治疗
患者应加强营养,宜进高蛋白、高能量、富含维生素的食物。平时应注意休息,尽力防止感染,避免精神刺激,避免过度劳累和激动,保持心情愉快,冬季加强保暖。[1]
病因治疗
对于病因明确的病人应尽量作病因治疗,如垂体及其邻近部位肿瘤引起者可做肿瘤切除或放射治疗。但很多情况下,腺垂体功能减退一经形成就无从作病因治疗(如产时或产后大出血以及垂体手术引起的腺垂体功能减退)。
内分泌治疗
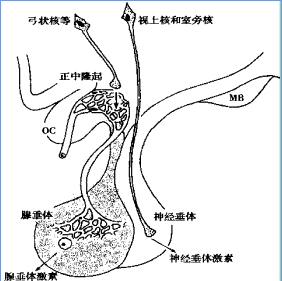
希恩综合征
(1)GH不足的治疗:儿童期起病者应积极补充GH,具体治疗方法同GH缺乏性侏儒症。成年起病者如存在GH不足,是否应补充GH尚无统一意见。不过,晚近的许多资料显示,补充GH具有改善生活质量,增加骨密度,减轻肥胖等益处。因此,对于经济条件许可者最好给予GH制剂。
(2)ACTH不足的治疗:ACTH不足是通过肾上腺皮质功能减退而表现出来的,且ACTH不能口服,补给不易,故目前一般通过肾上腺皮质激素的替代来纠正ACTH不足引起的症状。氢化可的松为生理性糖皮质激素,故为首选,12.5~25mg/d,清晨和午后2次服用,清晨剂量宜稍大于午后。也可选用可的松或泼尼松,可的松剂量可同氢化可的松,泼尼松为2.5~5mg/d。泼尼松需在肝脏转化后才具有活性,故有肝功能受损者不宜使用泼尼松。如存在应激(发热、感染、创伤等),应加大剂量,氢化可的松可用至200~300mg/d。补充糖皮质激素后,病人的体力和精神面貌可有明显改善,血压回升,排泄水负荷的能力增强。用药剂量过大可出现失眠、精神失常等症状,应予注意
(3)TSH不足的治疗:同ACTH不足的治疗一样,目前,也是采用甲状腺激素替代的方法来纠正TSH不足引起的症状。甲状腺激素替代治疗应从小剂量开始,逐渐增加剂量。如用甲状腺粉(片),可从20~40mg/d开始,每2周加量1次,每次可增加20mg,直至60~120mg/d,以后一直维持。用药量可根据季节调整,冬季气候寒冷,剂量宜稍大,夏季可略小。如用左甲状腺素钠,可从50μg/d开始,在数周内增至100~200μg/d;如用碘赛罗宁(T3可从10~20μg/d开始,在数周内增至50~75μg/d。碘赛罗宁(T3)作用快而短,不适于长期替代治疗,故目前一般多用甲状腺粉(片)或左甲状腺素钠。应该注意的是,甲状腺激素替代治疗应在糖皮质激素替代治疗的基础上进行,如单用甲状腺激素,可因代谢增加而加重糖皮质激素缺乏,甚至诱发危象。但如单用糖皮质激素,也可加重甲状腺激素缺乏,故应联合补充2种激素,且糖皮质激素替代应先于甲状腺激素替代
(4)LH/FSH不足的治疗:LH/FSH不足的治疗比较复杂,其治疗方案应根据年龄(少年还是成年)、性别、病变部位(下丘脑还是垂体)、有无生育要求而确定。青春期前起病者,无论男女其治疗的目标都是让病人获得正常的性发育并保持有效的性能力和生育能力。原发性(垂体性)LH/FSH不足者可补充促性腺激素,继发性(下丘脑性)LH/FSH不足者可补充促性腺激素或GnRH,在病人完成性发育及生育后可改用性激素治疗。青春期后起病且有生育要求者,如为原发性LH/FSH不足应补充促性腺激素,如为继发性LH/FSH不足可给予促性腺激素或GnRH。青春期后起病无生育要求者可给予性激素,男性给予雄激素制剂,年轻女性给予雌激素和孕激素以获得人工月经周期,老年女性可给予替代性雌激素。子宫完好者应给予孕激素(如甲羟孕酮),以免子宫内膜过度增殖诱发子宫内膜癌。
①GnRH的治疗:GnRH亦即LHRH,它于20世纪80年代初开始用于下丘脑性性腺功能减退症的治疗,它对垂体病变引起的性腺功能减退症和原发性性腺功能减退症无治疗作用。生理状态下,GnRH呈脉冲性分泌,男性大约每2小时释放1次,女性大约每90分钟释放1次。GnRH这种分泌特性为其生理效应所必需,因为持续给予GnRH将抑制LH/FSH的分泌(失敏现象)。因此临床上必须以脉冲的方式给药,这一般是通过GnRH泵输注的方法实现的。市售GnRH泵的脉冲释放频率可以自行调节,一般采用每90分钟或2小时释放1次。每个脉冲释出的药量以2.5~20μg为宜,少数男性病人可用至40μg。剂量过大可出现失敏现象,从而抑制垂体LH/FSH的分泌,于疾病不利。有少数病人在用药过程中可产生抗GnRH的抗体,抗体的出现将显著降低疗效。 GnRH脉冲式泵输注的疗效是肯定的。在女性,其诱导排卵的成功率达90%,同促性腺激素治疗相比,其引起多胎妊娠及卵巢过度刺激的机会大大减小,但其对合并有高雄激素的妇女疗效较差。在男性,GnRH治疗可使80%~95%的病人出现正常的性发育。同促性腺激素治疗相比,GnRH治疗能更快、更有效地促进睾丸的发育及生精作用。GnRH治疗能使50%~75%的病人精子数目达到正常水平。GnRH治疗在恢复精子的活力及形态方面则更为有效,因此,即使是治疗后精子数目未达到正常水平的病人仍有可能生育。在某些女性病人,雌激素拮抗药氯米芬也可诱发排卵。氯米芬能同雌激素受体结合而阻断雌激素对GnRH的负反馈抑制,使GnRH分泌增加,从而诱导排卵。但氯米芬由于有抗雌激素的副作用,目前已较少使用。
②促性腺激素治疗:主要的促性腺激素制剂有垂体源促性腺激素、重组FSH(recFSH。)、重组LH(recLH)、绒促性素(人绒毛膜促性腺激素)及尿促性素(人绝经后促性腺激素)。垂体源促性腺激素含有LH和FSH但来源有限,无实用价值,recFSH和recLH尚未推广应用,目前常用的为绒促性素(HCG)和尿促性素(HMG)。绒促性素(HCG)的作用与LH相似,在女性促进排卵,在男性促进雄激素的合成;尿促性素(HMG)亦称促月经素(menotropin),既含有LH也含有FSH,但以FSH为主,在女性主要促进卵泡成熟,在男性主要促进生精。促性腺激素治疗的对象主要为那些希望生育的病人。对女性病人来说,一般先给予尿促性素(HMG)使卵泡发育,待卵泡成熟后再用绒促性素(HCG)促发排卵。尿促性素(HMG)治疗目前提倡低剂量方案,可从75U/d开始,连续使用7~14天,如无卵泡成熟可将剂量加半(112.5U/d),再用7~14天,如还没有排卵,可再增加起始量的一半(150U/d),直至有卵泡成熟。目前,一般采用B型超声和监测血雌二醇浓度的方法来判断是否有卵泡成熟,卵泡直径达到17mm(B型超声测定)或血雌二醇升至1098 pmol/L(300pg/ml)以上为卵泡成熟的标志。有时虽无卵泡成熟但小卵泡较多,血雌二醇浓度仍可明显升高,因此,在判断卵泡是否成熟时卵泡直径较血雌二醇浓度更为可靠。在肯定有卵泡成熟后,应立即肌内注射绒促性素(HCG) 1~2天,5000~10000U/d,以诱发排卵。如果有多个卵泡同时成熟或接近成熟的卵泡过多,则不应给予绒促性素(HCG)以诱发排卵。排卵后可注射尿促性素(HMG) 2000U 2~3次或绒促性素(HCG) 5000U 1次以维持黄体的功能,也可阴道内给予微粒化的孕酮200~300mg/d。少数所谓“低反应者”需要较大量的促性腺激素制剂,对这些病人可联合应用GH,因为GH及其刺激产物IGF-I能增加卵巢对LH和FSH的反应。
上述治疗能使近90%的病人受孕(部分合并高雄激素血症的病人疗效较差),但流产的发生率和胎儿的围生期死亡率较高。治疗的主要副作用为过度刺激综合征(hyperstimulation syndrome)和多胎妊娠。过度刺激综合征为卵巢受FSH过度刺激所致,在治疗过程中的发生率约4%,其主要表现有:体重增加(超过3kg),腹痛,卵巢肿大、触痛。多胎妊娠的发生率20%~30%。男性病人亦可用促性腺激素制剂治疗,一般先单用绒促性素(HCG)(1500~2500U/次,每周2~3次,历时4~6周)使病人的睾丸充分发育,待血睾酮达正常水平后加用尿促性素(HMG)(75~300U/次,每周3次)以促进精子的产生。绒促性素(HCG)和尿促性素(HMG)的剂量个体差异很大,应根据病人的具体情况调整剂量。绝大多数病人治疗后能获得正常的性功能和生育能力。
总之,绒促性素/尿促性素(HCG/HMG)治疗的效果是肯定的,且其对下丘脑性促性腺激素不足和垂体性促性腺激素不足具有同样的效果。有学者指出,recLH和recFSH较绒促性素(HCG),尿促性素(HMG)更好,将来可能取代绒促性素(HCG)和尿促性素(HMG)。③性激素治疗:对于没有生育要求的病人,可不给予GnRH或促性腺激素制剂,而直接补给性激素以改善因性激素缺乏引起的症状。男性病人的性激素治疗:睾酮为最重要的生理性雄激素,性腺功能减退者每天需睾酮5~10mg,但睾酮口服后绝大部分在肝脏代谢成无活性或活性很低的产物,故口服睾酮难以达到有效的血药浓度。其他天然雄激素亦是如此。
雄激素制剂多为人工合成的睾酮衍生物,可分为3类:第1类为睾酮17α位烷化后的产物,如美雄酮(去氢甲睾酮)、甲睾酮等;第2类为睾酮酯类,即睾酮17β羟基酯化后的产物,主要有丙酸睾酮、醋酸西美诺龙(methenolone acetate)、十一酸睾酮等;第3类为睾酮A,B,C环修饰后的产物,如氟甲睾酮、19-去甲睾酮(19-nortestosterone)等。烷基化睾酮衍生物吸收快,在肝内降解慢,故能达到有效的血药浓度,但其烷基对肝细胞损害较大,故目前已很少使用。睾酮酯类为脂溶性,水解为睾酮后发挥作用。大多数睾酮酯类不能口服,但醋酸美雄酮(甲基雄烯醇酮)和十一酸睾酮可口服,前者经肠道淋巴系统直接体循环,后者因有甲基使肝脏对其灭活作用减弱故能维持有效血药浓度。环修饰睾酮衍生物作用强大,但也有损肝作用。目前,使用最多的为睾酮酯类。长效睾酮酯类(如庚酸睾酮)可2~4周肌注1次,200~250mg/次;短效制剂如丙酸睾酮需每2~3天肌注1次,25~50mg/次。十一酸睾酮可口服,剂量为80~160mg/d,该药半衰期短,故每天药量应分2~3次口服。十一酸睾酮已有微粒化制剂,每天给药1次即可。睾酮酯类治疗可使病人维持第二性征和性功能。对于青春期前患者,也可使用雄激素以诱导青春期性发育,一般从12~14岁开始,起始剂量宜较小,以后缓慢加量。如选用睾酮酯类,可每月每平方米体表面积增加50~100mg。雄激素制剂只能诱导和维持第二性征,生精作用甚弱,故对青春期前患者宜给予GnRH或促性腺激素制剂,雄激素制剂可作为辅助药物。睾酮贴片亦已问世,贴片里的睾酮可经皮吸收而避免肝脏的首过灭活。睾酮贴片提供的为生理性雄激素,副作用较少。雄激素治疗常见的副作用有:体重增加、血红蛋白增高、痤疮、前列腺癌(老年男性)、钠潴留。雄激素制剂在外周可被转变成雌激素,故有些病人(特别是肝功能不佳者)在治疗过程中出现女性化症状,最常见的女性化症状为男性乳房发育。青春期前患者如雄激素剂量过大可致骨骺闭合过早,其成年身高将受影响。烷基化睾酮衍生物还可引起血脂异常(HDL-Ch降低,LDL-Ch升高)并损害肝功能,严重者可致紫癜性肝病(purpuric hepatis)。女性病人的性激素治疗:没有生育要求的女性病人可仅给予性激素治疗,有生育要求者应以GnRH或绒促性素/尿促性素(HCG/HMG)治疗为主,但性激素治疗亦可作为辅助手段。
病人的年龄对选择治疗模式很重要:对育龄妇女应予周期序贯治疗;对绝经后女性则可仅给予雌激素或雌、孕激素持续性联合应用。单纯雌激素疗法:可有效地改善雌激素不足的症状如血管舒缩功能紊乱、失眠、紧张焦虑、记忆力下降、注意力不集中、萎缩性阴道炎、阴道黏膜萎缩性出血、性欲降低、性感缺失、性交困难等,并能预防骨质疏松、降低心血管疾病的危险性。但单用雌激素不能造成月经,对女性的心理健康不利,故50岁以下的妇女一般不采用此种治疗方法。生理性雌激素制剂如雌二醇、雌三醇口服后大部分在肝脏灭活,故目前多采用其微粒化制剂或贴片。戊酸雌二醇及结合雌激素(conjugated estrogen)口服有效,其剂量分别为1~2mg/d,0.3~0.625mg/d。周期序贯疗法:每月用雌激素25天,在用药的后10天加用孕激素,停药后出现子宫内膜出血,即所谓人工月经。常用的孕激素及其剂量如下:甲羟孕酮(安宫黄体酮)5~10mg/d,二甲脱氢孕酮(medrogesto ne)5mg/d,脱氢逆孕酮(dydrogesterone)10~20mg/d,醋酸氯羟甲烯孕酮(cyprogesterone acetate,CPA)1mg/d,微粒化孕酮200~300mg/d,去氧孕烯(地索高诺酮)0.15mg/d,醋酸炔诺酮(nore thisterone acetate,NEPA)1mg/d,炔诺孕酮(norgestrel,NORG)0.15mg/d。雌、孕激素持续性联合疗法:雌激素用量同上,孕激素为上述剂量的1/3~1/2,不停药,此法无子宫内膜出血。雌激素可使子宫内膜癌和乳癌发病率增加;孕激素不增加乳癌发病率,而且可有效地对抗雌激素诱发子宫内膜癌的作用。
研究表明,接受周期序贯疗法和雌、孕激素持续性联合疗法的病人子宫内膜癌的发病率并无增加,因此目前认为,只要病人有子宫就应同时给予孕激素。由于性激素补充治疗能有效地降低心血管疾病的发病率和死亡率,并可减少发生骨质疏松的机会,因此,从整体的角度来说,这种治疗对病人利大于弊。实际上,长期治疗可使病人的预期寿命增加2~3岁。更重要的是,治疗可大大提高病人的生活质量。
危象治疗
(1)针对诱因的预防和治疗措施:避免受寒、饥饿、外伤、感染。如因某种原因出现呕吐、腹泻、脱水,应立即给予相应处理。病人如需手术,应做好术前准备,麻醉时更应小心,药物剂量宜小,麻醉或术中出现问题应立即处理。有感染者,积极抗感染。
(2)纠正低血糖:一般先静脉注射50%葡萄糖溶液40~60ml,继以10%葡萄糖溶液或5%葡萄糖生理盐水静脉滴注。应同时给予糖皮质激素,这也有助于纠正低血糖。由于病人体内升糖激素总是不足的,故即使血糖不低也应补充葡萄糖。
(3)补充糖皮质激素:危象病人糖皮质激素的缺乏多很严重,故应积极补充。一般采用生理性制剂氢化可的松(皮质醇),可在10%葡萄糖溶液500ml中加入氢化可的松(皮质醇)100mg静脉滴注,首日用量200~300mg。如为水中毒型宜先静脉推注氢化可的松25mg(溶于25%葡萄糖溶液40ml中),继以上述剂量静脉滴注。如无感染等严重应激存在,且体温低,可减小用量,因为此类病人如氢化可的松用量过大可加重甲状腺激素的缺乏,从而使昏迷加重。
(4)补充血容量:循环衰竭型垂体危象病人失液、失盐严重,应尽快补足血容量。可静脉滴注5%葡萄糖生理盐水,补液量及NaCl用量视失液、失盐程度及心功能而定。
(5)保暖:低体温型垂体危象应加强保暖。此型多有较严重的甲状腺激素缺乏,宜补充甲状腺激素。碘塞罗宁(三碘甲腺原氨酸)作用快,为首选,每6小时静脉注射25μg;如无针剂,可每6小时口服20~30μg。不能口服者(如昏迷病人)则鼻饲给药。如无碘塞罗宁(T3),T4或甲状腺粉(片)亦可。T4的用法为每6小时给25~75μg,甲状腺粉(片)的用法为每6小时给30~45mg。在补充甲状腺激素的同时应给予适量的氢化可的松,但其剂量不宜过大。体温不低者,也可给予小量甲状腺激素。体温升高者一般不用甲状腺激素。
注意事项
可疑垂体危象病例,禁用或慎用吗啡等麻醉剂、巴比妥安眠药、氯丙嗪等中枢神经抑制剂及各种降血糖药物,以防止诱发昏迷。对精神失常或神志不清者,应加强安全防范护理,防止发生意外。提供合理饮食,保障营养。预防对某些原因引起的腺垂体功能减退症可通过加强预防措施而免于发病,如提高孕妇的保健水平可减少产后垂体坏死引起的腺垂体功能减退症;提高脑外科及放射治疗的水平有助于减少这些因素引起的腺垂体功能减退症。